zur historischen Entwicklung der Anwendung von Procain
Einleitend weise ich zunächst auf die Vorträge von Wander (siehe Fortbildung bei DGfAN) und Arbeiten von Hahn-Goddefroy hin. Anschließend versuche ich chronologisch darzustellen, wie sich parallel Ideen, Erfahren und Forschungen entwickelt haben bzw. sich aktuell beeinflussen.
- 1600 komprimiert Valverdi Nerven und Gefäße zur Betäubung vor einer Operation
- 1664 nutzt Severino Schnee und Eis(würfel) zur örtlichen Betäubung
- 1664 idendifiziert und beschreibt Willis den Sympathikus
- 1767 wiesen Bordeu in Paris und 1854 Reichert in Dorpat auf die Bedeutung des Bindegewebes bei Krankheiten hin
- 1801 führt Bichat den Begriff des vegetativen Nervensystems ein
- 1813 stellt Ling die klassische Massage, aus der sich zahlreiche Variationen entwickeln, vor
- 1839 erreichen Lundy, Taylor und Washington durch Einritzung von Morphin unter die Haut eine reflektorische Schmerzreduktion
- 1843 beschreibt Froriep die rheumatische bzw. Bindegewebs-Schwiele
- 1843-53 entwickeln Pravaz und Wood die Injektionsspritze und Rhynd die Hohlnadel bzw. –kanüle
- 1851 beschreibt Bernard die nervale Steuerung der Vasomotorik
- 1855 isoliert Goedecke ein Alkaloid aus Coca-Blättern und 1860 Niemann das Kokain, einem chemischen Verwandten von Procain
- 1869 beobachtet Horner die Trias: Miosis, Ptosis und Enophthalmus
- 1883 erläutert Pawlow den „Nervismus“ und prägt den Begriff „Ganzheitsmedizin“
- 1883/4 wendete Koller erstmals Kokain nach Interaktion mit Freud zur örtlichen Betäubung bei einer Star-Operation, 1885 Halsted bei Zahnoperationen und 1886 Frank an einem Ganglion an
- 1886 entdeckt Weihe schmerzhafte Druckpunkte, welche vielen Akupunkturpunkten entsprechen
- 1888 entwickelt Oberst die Fingerbasis-Anästhesie
- 1891-2 stellt Schleich die Wirkung des Kokain als „beste antineuralgische Methode mit Überdauerungseffekt“ vor und empfiehlt die örtliche Betäubung
- 1892 optimiert Reclus die Dosis von Kokain von 30% auf 0,1% wegen des Suchtpotentials
- 1893-8 beobachtet der englische Neurologe Head segmentbezogene Sensibilitätsstörungen (Hyperästhesie und -algesie) der Haut bei Erkrankungen der inneren Organe
- 1898 beschreibt Spieß den „antientzündlichen“ Effekt von Kokain
- 1898 führt Bier die „Kokainisierung des RM“ im Selbstversuch durch und 1908 die intravenöse Anästhesie ein
- 1903 führt Cathelin eine Epiduralanästhesie mit Kokain durch
- ab 1901 entwickelt Einhorn das Produkt Novocain® (Wirkstoff: Procain) und führt es 1905 mit Ulfelder ein
- 1906 beschreibt Spieß die „Heilwirkung von Novocain®“
- 1906 bestätigt Wischnewski die antientzündliche Wirkung des Procains
- 1906 führt Läwen mit Sellheim die paravertebrale Anästhesie und 1911 Blockaden der Nn. femoralis und ischiadicus durch
- 1908 führt Stoeckel die Caudalanästhesie in der Geburtshilfe ein
- 1910 empfiehlt Braun Injektionen bei Trigeminus-Neuralgie
- 1912 propagieren Härtel Injektionen an Ganglion des Trigeminus, Hirschel die axilläre Plexusblockade und Kulenkampf die supraklavikluläre Plexusblockade
- 1913 prägen Pässler den Begriff der Fokalerkrankung sowie wenig später Gutzeit und Parade den des„Focus“
- 1917 beobachtet der schottische Chirurg Mackenzie segmentbezogene Störungen (Hypertonus) der Muskulatur bei Erkrankungen der inneren Organe
- 1920 – 1925 infiltriert Leriché die Art. temporalis bzw. das Ganglion stellatum bei Morbus Raynaud, Frakturen und Migräne und sagt: „Das Novocain ist das unblutige Messer des Chirurgen.“
- 1924 beschreibt Ricker die Relationspathologie mit zentraler Rolle des perivaskulären Sympathikus bei Reizung
- 1925 injiziert F. Huneke bei seiner Schwester versehentlich Atophanyl® mit Procain i.v. und beschreibt mit W. Huneke nach zahlreichen intra- und paravenösen sowie sub- und intrakutanen Procain-Infiltrationen 1928 „unbekannte Wirkungen der Lokalanästhetika – Heilanästhesie“
- 1927 beschreibt Fontaine Procain-Wirkungen auf Gefäße nach Traumen
- 1929 führt Frau Elisabeth Dicke eine erste Bindegewebsmassage im Eigenversuch bei einer arteriellen Durchblutungsstörung des Beines erfolgreich durch und demonstriert dies 1938 Kohlrausch, welcher mit Frau Teirich-Leube 1953 den Verlauf der Zonen und Grundlagen der Reflexzonenmassage beschreibt
- 1934 beschreibt Leriché eine „Heilung im Augenblick“
- 1936 heilen Bayer Magengeschwüre, 1937 Kulenkampff Epididymitiden, 1938 Fenz Ischias mit Infiltrationen
- ab 1936 beschreibt Selye die grundlagen von Stress sowie die Auswirkungen auf die Hypophyse und Nebenniere
- 1938 beschreibt Hansen mit van Staa reflektorische und algetische Krankheitszeichen und 1962 mit Schliack die segmentale Innervation innerer Organe
- 1940 entdecken F. und W. Huneke das „Sekundenphänomen“ nach Quaddelung einer Narbe in der re. Tibia mit sofortiger Schmerzlinderung in der li. Schulter und definieren das „Störfeld“
- 1940 übersetzt Roques ein Buch vom Pawlow-Schüler Speranski („Grundlagen der Theorie der Medizin“) und gibt der Heilanästhesie den Namen „Neuraltherapie nach Huneke“
- 1943 wird das Lidocain eingeführt
- 1947 beschreibt Scheid Aufzweigungen des vegetativen Nervensystems bis zu den Zellen
- 1948 führt Wiener Grundlagen der Kybernetik in die Medizin ein
- 1949 diagnostiziert und therapiert Kibler innere Erkrankungen über ihre dermatologischen Störungsfelder
- ab 1949 injiziert Frau Ana Aslan erfolgreich Procain in Gefäße und beschreibt Permebilitätsveränderungen
- In den 1950er Jahren praktizieren Goecke und Mitarbeiter die parazervikale Infiltration
- Parallel erarbeiten Fleckenstein und Kollegen erste molekulare Grundlagen über die Wirkung der LA am Natrium-Ionen-Kanal
- 1953 veröffentlichen Travell und Simons die Theorie der Triggerpunkte und darauffolgend die Grundlagen zum referred pain
- 1963 gibt Dosch das erste Lehrbuch für Neuraltherapie in Deutschland heraus
- Weitere Bücher folgen von Barop, Lorenz, Bergsmann und Bergsmann, welche erstmals den Begriff des Bewegungssegmentes von Junghans in segment-reflektorischen Komplex erweitern
- Ab 1965 ist es v.a. Melzack, der u.a. mit Wall neben der „gate controll theorie“ zahlreiche Arbeiten zum Schmerz und dessen Hemmung bzw. Verarbeitung veröffentlicht
- 1973 behandelt diesen Komplex Mink mit seiner bahnbrechenden Technik bei Frauenleiden und Rückenschmerz
- Im gleichen Jahr veröffentlicht Adler seine Daten zu Nackenreflexpunkten und Zahnleiden
- In den 70er Jahren differenziert Langer die Punkte und erarbeitet eine Untersuchungstechnik sowie Bezüge zu den Augen- und HNO-Störungen
- 1983 betrachten Pischinger und seine Kollegen aus Wien endgültig die Zelle als morphologische Abstraktion und sieht sie ohne Milieu (Grundsubstanz) nicht als biologisch lebensfähig
- Ab den 1980er Jahren erforscht Heine nicht nur anatomische Zusammenhänge des Akupunkturpunktes und beschreibt die Grundregulation in der extrazellulären Matrix, sondern auch die biochemische Wirkung der Procain-Spaltprodukte auf Gefäße, Ödeme, Ceramid-Bildung und das Endocannabinoid-System
- In den 1990er Jahren arbeitet Hahn-Godefroy alle Daten zu Procain auf und kritisiert die unwissenschaftlichen Behauptungen zu zahlreichen Nebenwirkungen von Procain, wozu auch die zu hoch angegebene Allergierate zählt (siehe www.neuraltherapie-blog.de)
- Auch Tilscher und Eder veröffentlichen in den 1990 er Jahren extrem niedrige Nebenwirkungsraten von 0,03% bei der Behandlung des segment-reflektorischen Segmentes (SRK) an ca. 264000 Patienten
- 1991 vervollständigt Becke das Modell des SRK bei der Neuraltherapie vom Keuzschmerz und der Migräne
- Ab 1995 folgen basiswissenschaftliche Erklärungen zur Wirkung von LA auf Lysophosphatidatsäure-Rezeptoren, auf die Thrombozytenaggregation, Entzündungskaskade und Schmerzverarbeitung durch Durieux und Kollegen
- U.a. beschreibt Honemann ab 1999 die zelluläre Wirkung der LA, ohne dass ein Wirkspiegel zur Hemmung der Ionenkanäle vorliegt
- Nun veröffentlichen v.a. Hollmann, Herroeder und Hahnenkamp die antiinflammatorische Wirkung der LA an G-Protein-gekoppelten Rezeptoren. Die postoperative sowie gastrointestinale Wirkung der LA ist dabei von globalem Interesse.
- Die Neuraltherapie ist mittlerweile Gegenstand der wissenschaftlichen Lehre (u.a. in Bern, Graz, Heidelberg, Essen sowie Osteuropa und Südamerika) geworden. Zur Verbesserung der Evidenz werden klinische Studien in Deutschland durchgeführt. So veröffentlicht u.a. Weinschenk ab 2002 auch prospektische Studien mit der HUNTER-Group in Heidelberg zur Wirkung und Nebenwirkung diverser Techniken unter Anwendung von Procain, Lidocain und Mepivacain.
- 2003 veröffentlicht Villar-Garea sogar die demethylierende Wirkung von Procain und 2012 Lirk die des Lidocains in Krebszellen
- In den darauffolgenden Jahren folgen immer mehr Arbeiten zu „Störfeldern“ und Wirkungen der LA bzw. des Procains durch Uehlecke, Weinschenk, Graf und Kollegen.
- 2011 wurde von Joos und Mitarbeitern veröffentlicht, dass das „Quaddeln“ die am meisten angewendete und erfolgreich Methode in einer deutschen Arztpraxis ist.
- 2014 führen Saha und Wander den Begriff des neuromodulativen Triggers ein und beschreiben die Wirkung von Störfeldern auf das Vegetativum, Endokrinum und Immunsystem.
- Aktuell bemühe ich mich mit den Dozenten der Deutschen Gesellschaft für Akupunktur und Neuraltherapie (DGfAN) unter der Leitung von R. Wander, anderen Neuraltherapeuten (u.a. S. Weinschenk und der so genannten HUNTER-Group der Universität Heidelberg) sowie der Internationalen Gesellschaft für autonome Funktionsdiagnostik und Regulationsmedizin (IGAF) praktische Hinweise zur Planung, Durchführung, Dokumentation (u.a. mit der Herz-Raten-Variabilitätsanalyse bzw. HRV [13]) und Lehre bei der Anwendung von Procain u.a. LA im Rahmen der Neuraltherapie zu erarbeiten.
biochemische Grundlagen und Pharmakologie
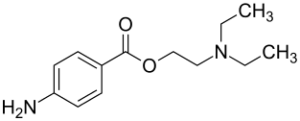
aus wikipedia.org
Das 1905 synthetisierte Ester Procain wurde aufgrund seiner chemischen Verwandschaft zunächst Novocain® („das neue Cocain“) genannt. Heuer existieren zahlreiche Generika von Novocain und andere Ester wie Chlorprocain und Tetracain, welche zwar potenter sind, jedoch nur zur Oberflächenanästhesie (Tetracain) bzw. in der Schweiz (Chlorprocain) Anwendung finden. Im Gegensatz zum Procain sind letztere nicht ausreichend untersucht. [11] Procain ist ein Ester aus einer aromatischen Säure (Para-Amino-Benzesäure bzw. PABA) und einem Alkohol (Di-Ethyl-Amino-Ethanol bzw. DEAE). Die Verwandschaft zur Folsäure und zum Cholin ist nicht zu übersehen. [16] Procain hat ein Molekulargewicht von 236, bei 25°C einen pk-Wert von 9,05 und einen schlechten Verteilungskoeffizienten. Es penetriert bzw. diffundiert schlecht bzw. nicht in Knochen sowie saures Gewebe, wird am Ort durch die ubiquitär vorkommende Pseudo-Cholin-Esterase (ein genetischer Bruder der Cholin-Esterase der Leber bei Chordatieren) nahezu vollständig abgebaut, so dass keine Plasmabindung nachweisbar ist. Es ist nicht myo- und neurotoxisch. Die Plasma-Clearance beträgt ca. 5,6 l/kg/h. Die max. Dosis wird mit 6-7,5mg/kg KG (entspricht bei 70kg KG ca. 500mg bzw. bei einer 1%igen Lösung 50ml!) angegeben. Es wirkt am Natrium-Ionen-Kanal ca. 30 min und wie alle Lokalanästhetika am G-Protein-gekoppelten Rezeptor bzw. GPCR antientzündlich und antithrombotisch deutlich länger. [32]
Im Gegensatz zu allen anderen LA wirken die o.g. Spaltprodukte PABA und DEAE (s.u.).
klinische Anwendungen und experimentelle Wirkungen
Am peripheren Nervensystem (PNS) wirkt es wie alle Ester und Amide anästhetisch (lähmend bzw. betäubend) durch die reversible Blockung des Natrium-Ionen-Kanals. [10] Je nach Dosis und Injektionsort werden zuerst myelinfreie bzw. schmalere Fasern erreicht.
So wirkt es am vegetativen Nervensystem (VNS) nicht nur „blockierend“ und damit para- und sympathikolytisch, sondern auch „alternativ“, d.h. über die Inhibition der G-Protein-gekoppelten Rezeptoren (v.a. Gaq). [17,21]
Am zentralen Nervensystem (ZNS) wirkt es v.a. über das Spaltprodukt Diethylaminoethanol (DEAE) und fördert Lernprozess und Konzentration bzw. wirkt gegen Müdigkeit und Depression. [14]
An der Herzmuskulatur wirkt Procain wie alle LA zunächst negativ inotrop, chronotrop, dromotrop und bathmotrop, antiarrhythmisch, aber auch koronarperfusionssteigernd. [28]
An der Muskulatur und den Hohlorganen wirkt Procain durch direkte Wirkung am muskarinergen Rezeptor vom Typ M1 und M3 relaxierend und damit tonusregulierend bzw. spasmolytisch. [18,20]
An den Gefäßen treten verschiedenen Effekte auf. So wirkt es über die Sympathikolyse und GPCR relaxierend, über DEAE vasodilatativ [22,41] und über PABA kapillarabdichtend. [2,16] Dies wurde 1970 von Aldrete und Johnson als Allergie nach Setzen von Hautquaddeln fehlgedeutet und wird von zahlreichen Kollegen heute noch als Argument gegen die Anwendung von Procain benutzt. [16, www.neuraltherapie-blog.de)
In den endokrinen Organen bzw. Hormonsystem wurden regulierende Effekte (Hemmung der HMG-CoA-Reduktase) beschrieben. [44]
Am Immunsystem sind antihistaminische und antiinflammatorische Effekte durch die Hemmung der Sekretion von Interleukinen und dem „priming“ v.a. der Neutrophilen [16,17,19] und die der karzinogenen Methylierung durch Hemmung der DNA-Methylase [40] gefunden worden.
zusätzliche Wirkungen der Spaltprodukte
PABA wirkt zusätzlich antihistaminerg in Form der Membranstabilisierung. Es bindet Ceramid, ein bei Entzündungen aus dem Endothel entstehendes Sphingomyelin, welches Mitochondrien zerstört und für den Zelltot verantwortlich sein kann. [16]
DEAE passiert die Blut-Hirn-Schranke und hat einen lern- und konzentrationsfördernden bzw. antidepressiven Effekt. Es bindet langkettige ungesättigte Fettsäuren, welche durch Phospholipase 2 aus der Membran gelöst werden, und verhindert somit die Hemmung der Fettsäure-Amid-Hydrolasen (FAAH), was zur Erhöhung der Endocannabinoide (EC) im Gewebe führt und den Parasympathikus aktiviert. Im Stress entstehen nämlich durch (Nor)Adrenalin Vanilloide, welche die Endocannabinoid-Rezeptoren besetzen. Umgekehrt können durch Procain die ansteigenden EC die Vanilliod-Rezeptoren des Sympathikus besetzen und der neurogenen Entzündungen entgegenwirken. [6,16,38]
Literatur
- Adler, E (1973) Erkrankungen durch Störfelder im Trigeminusbereich. Fischer, Heidelberg
- Aslan A, David C, Campeanu S (1959) Der Einfluss der Dauerbehandlung mit Novocain auf die differenzierte Kapillarpermeabilität. Arzneimittel-Forschung, IX/9
- Badtke G, Mudra I (1998) Neuraltherapie. , vollst. überarb. und erw. Aufl. Ullstein Medical
- Becke H (1991) Neuraltherapie bei Kreuzschmerz und Migräne. Hippokrates
- Bergsmann O, Bergsmann R (1993) Einfache Neuraltherapie für die Tägliche Praxis. 3. unveränd. Aufl. Facultas
- Caligniano A et al. (1998) Control of pain irritation by endogenous cannabinoids. Nature. 394: 277-81
- Dosch P (1995) Lehrbuch der Neuraltherapie nach Huneke. 14. erw. Aufl. Haug
- Emrich O, Richthammer I (2010) Geschichte. In Weinschenk S (Hrsg) Handbuch der Neuraltherapie. Urban&Fischer
- Fischer L (2001) Neuraltherapie nach Huneke. 2. überarb. Aufl. Hippokrates
- Fleckenstein A (1954) Der Mechanismus der Erregung und Erregungshemmung mit spezieller Berücksichtigung des Novocains. Anästhesist 3(1): 15-9
- Gold-Szklarski K, Weinschenk S (2010) Procain oder Lidocain? Die Verwendung von ester- oder amidstrukturierten Lokalanästhetika. In Weinschenk S (Hrsg) Handbuch der Neuraltherapie. Urban&Fischer
- Graf K (2011) Immunologisch relevante Belastungen aus zahnärztlichen Werkstoffen und deren Wirkungen. umwelt-medizin-gesellschaft 24/2: 112-5
- Günter U (2015) Die gemeinsamen Grundlagen von Akupunktur und Neuraltherapie. Naturheilk.5: 44-6
- Heine, H (1987) Die Grundregulation aus neuer Sicht. Ärztezeitschrift für Naturheilverfahren 28: 909
- Heine H (2006) Neuraltherapie nach Hunecke. Zur Molekularbiologie von Procain. Ärztez Naturheilverf 47: 601-5
- Heine H (2010) Pharmakologie der Spaltprodukte von Procain und das Endocannabinoidsystem. In Weinschenk S (Hrsg.) Handbuch der Neuraltherapie. Urban&Fischer, München: 99-102
- Herroeder S, Hollmann M (2010) Alternative Wirkmechanismen von Lokalanästhetika. In Weinschenk S (Hrsg.) Handbuch der Neuraltherapie. Urban&Fischer, München: 93-9
- Hollmann MW, Fischer LG, Brydford AM, Durieux ME (2000) Local ansesthetic inhibition of m1 muscarinerg acetylcholin signaling. Anesthesiology 95: 497-509
- Hollmann MW, Gross A, Jelacin N, Durieux ME (2001) lokal anesthetic effect on priming and activation of human neutrophils. Anesthesiology 95: 113-22
- Hollmann MW, Wieczorek K, Smart M, Durieux ME (2001) Epidural anesthesia prevents postoperative hypercoagulation in patients undergoing major orthopedic surgery. Reg Anesth Pain Med 26:215–222
- Hollmann MW, Wieczorek KS, Berger A, Durieux ME (2002) Local anesthetic inhibition of G protein-couplet receptor signaling by interference with Gq protein function. Mol Pharmacol 59:294-301
- Huang Y et al (1999) Contribution of nitric oxide and K+ channel activation to vasorelaxation of isolated rat aorta induced by procaine. Eur J Pharmacol 367
- Hunecke F (1943) Unbekannte Fernwirkungen in der Lokalanästhesie. Fortschritte der Medizin. Z des praktischen Arztes 52: 213-23
- Hunecke F (1953) Das Sekundenphänomen. Neuralmedizin 1: 72-5
- Joos S, Musselmann B, Szecsenyi J (2011) Integration of complementary and alternative medicine into family practices in Germany: results of a national survey. Evid Based Complement Alternat Med. 2011:495813
- Langer H (1994) Sonderdruck aus ZÄN 10/35: 712-716
- Langer H (1994) in Dosch (Hrsg) Aktuelle Beiträge zur Neuraltherapie nach Huneke. Bd 15, Haug
- Löscher W (2003) Lokalanästhetika. In: Löscher W, Ungemach FM, Kroker R (Hrsg.) Pharmakotherapie bei Haus- und Nutztieren. 6. Aufl. Parey Buchverlag, Blackwell: 109-14
- Melzack R, Wall PD (1965) Pain Mechanism. A new theory Science 150: 971
- Mink E (1973) Procaintherapie nach Huneke in der Gynäkologie. Medizinischer Verlag
- Niesel HC, Van Aken H (2003) Lokalanästhetika, Regionalanästhesie, Regionale Schmerztherapie. 2. überarb. Aufl. Thieme
- Niesel HC (2010) Pharmakologie und Toxikologie der Lokalanästhetika. In Weinschenk S (Hrsg.) Handbuch der Neuraltherapie. Urban&Fischer, München: 86-92
- Pischinger A (1969) Über das vegetative Grundsystem. Med. u. Reh.: 37
- Ricker G (1924) Pathologie als Naturwissenschaft – Relationspathologie. Springer
- Saha FJ, Wander R (2014) Das Störfeld als neuromodulativer Trigger auf allen Ebenen. Deutsche Zeitschrift für Akupunktur 57/2: 6-9
- Selye H (1952). Einführung in die Lehre vom Adaptationssyndrom. Thieme, Stuttgart
- Schmidt H (2007) Pharmakologie und Toxikologie. Schattauer, Stuttgart
- Schulze-Osthoff et al. (1992) Cytotoxic activity of tumor necrosis factor is mediated by early damage of mitochondrial functions: evidence for the involvement of mitochondrial radical generation. J Biol. Chem. 267: 517-23
- Uehleke B, Ludtke R, Albrecht U, Stange R (2006) Associations between chronic affects of tonsils, induration of connective tissue areas of brachialgia paresthetica nocturna. Forsch. Komplementärmed. 13 (4): 220-6
- Villar-Garea A, Fraga MF, Espada J, Esteller M (2003) Procaine is a DNA-demethylating agent with growth-inhibitory effects in human cancer cells. Cancer research 63/16: 4984-9
- Waaben J et al (1984) Haemodynamic effects of intravenous procaine as a supplement to general anaesthesia in patients with valvular heart disease. Acta Anaesthesiol Scand 28
- Weinschenk S (2007) Wirkung der Neuraltherapie an der Zellmembran – die molekulare Erklärung des Störfelds? Komplement. Integr. Med. 1: 37-41
- Weinschenk S, Hollmann MW, Göllner R, Picardi S, Strowitzki T, Diehl L, Hotz L, Meuser T (2016) Injections of Local Anesthetics into the Pharyngeal Region Reduce Trapezius Muscle Tenderness. Forsch. Komplementmed. 23(2):111-6
- Xu J, Lecano L, Hahn Z, Yao Z, Greeson J, Papadopoulos V (2003) Inhibition of adrenal cortical steroid formation by procain is mediated by reduction of cAMP-induced 3-hydroxy-3-methylglutaryl-coenzym A reductase messenger ribonuclein acid levels. J Pharmacol Exp Ther 307(3): 1148-57


