Abb. aus Niesel und Van Aken
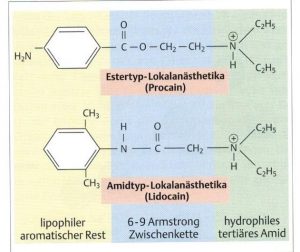
Lokalanästhetika (LA) sind amphile Ester oder Amide mit einem lipophilen aromatischen Rest und einer hydrophilen polaren Stickstoffverbindung. Sie unterscheiden sich in der Zwischenkette bzw. anhand der Liganden. In einer wässrigen Lösung verändert sich je nach ph-Wert der pk-Wert (Verhältnis zwischen der ungeladenen basischen sowie der geladenen kationischen Form), so dass bei einem neutralen ph-Wert 30-40% des LA als basischer Anteil vorliegt, welcher diffundieren kann (cave: saure Entzündung). Ester bzw. LA mit einem hohen pk-Wert haben somit schlechtere Verteilungskoeffizienten. Amide penetrieren besser ins Gewebe. LA durchdringen nicht die intakte Haut (Ausnahme: z.B. Tetracain) und müssen intrakutan, subkutan und tiefer injiziert werden. Einige (z.B. Procain und Lidocain) wirken auch systemisch nach intravenöser Gabe. Die Wirkung vor Ort ist konzentrations- und dosisabhängig. Ester werden vorwiegend vor Ort durch ubiquitär vorkommende Esterasen und Amide erst in der Leber abgebaut. Ihre Halbwertzeiten schwanken von 15 min (Procain) bis mehrere Stunden (z.B. Bupivacain, Ropivacain). Es entstehen teilweise toxische Substanzen (z.B. bei Lidocain), welche ausgeschieden werden müssen. So sind Amide generell toxischer als Ester. Haltbar sind LA nur als Hydrochlorid. Stabilisatoren erhöhen gerade in Durchstechflaschen jedoch zusätzlich die Toxizität und Allergenität aufgrund der Konservierungsstoffe und Verschlüsse. [1,2]
Durch Kalium-Ionen entsteht ein elektrischer versus einem chemischem Gradienten. Proteine und Phosphate „halten“ die nach außen strömenden Ionen an Außenseite der Zellmembran „fest“. Dadurch entsteht an Herz-, Skelettmuskel- und Gliazellen ein Ruhemembranpotential von -90mV bzw. in allen Zellen von -70mV. Durch den Einstrom von Natrium-Ionen nach dem „Öffnen“ spezifischer Ionen-Kanäle entsteht ein Aktionspotential mit Ausgleich des Membran-Potentials bis zu 40mV. [1,2] Erst durch einen ATP-verbrauchenden Prozess kommt es zur „Repolarisation“. LA blockieren den Natrium-Kanal und lassen damit kein Aktionspotential durch Reiz jeder Art zu. [1,2,3] Dabei muss das LA über seinen lipophilen Anteil nach intrazellulär und „blockiert“ über seinen hydrophoben Anteil die Depolarisation. Je höher die Konzentration und Proteinbindung des LA ist, desto „wirksamer“ ist es. Zuerst wird der perivaskuläre Sympathikus, dann die Nozizeptoren bzw. Kälte-, Wärme-, Berührungs- und Druck-Rezeptoren „geblockt“. Je höher die Lipophilie ist, desto „lähmender“ wirkt das LA. [4]
In den jüngeren Jahren sind Effekte aller LA am Lysophosphatidatsäure-Rezeptor [5], am Thromboxan-Rezeptor [6], an muskarinergen Rezeptoren Typ 1 und 3 über isolierte G-Protein-gekoppelte Rezeptor (GPCR) mit differenzierten Untereinheiten [7,8] mit verminderter Freisetzung von gerinnungsaktiven Substanzen, Acetylcholin, Interleukinen und Monocyte-Chemoattractant-Protein-1 (MCP-1) erforscht worden. [9] Procain ist zusätzlich durch die Spalt-Produkte Paraaminobenzoesäure (PABA) und Diethylaminoethanol (DEAE) [10], durch die Hemmung der HMG-CoA-Reduktase [11] sowie demethylierende Wirkung auf die DNA [12] von großem Interesse in der Forschung.
Das seit den 1940er Jahren synthetisch hergestellte Lidocain zum bei fast allen o.g. Indikationen (v.a. kurze ambulante bzw. „überschaubare“ Therapien) und je nach Erfahrung und Ausbildung der Ärzteschaft (v.a. in Österreich) zur Anwendung. Ich wende es nicht bei Schwangeren und „Leberkranken“ an, da das karzinogene Spaltprodukt 2,6 Xylidin im Tierversuch gefunden wurde und es in der fetalen Leber nur verlangsamt abgebaut wird. [15] Auch intramuskulär sollte es nicht angewendet werden, da es wie alle Amide deutlich häufiger und stärker als Ester myotoxisch wirken kann. [16,17] Es hat eine Wirkdauer von ca. 60 – 120 min und kann als 0,5, 1 oder 2 %ige Lösung bis zu 3mg/kg KG als Infusion und bis 4mg/kg KG als Injektion angewendet werden (bei 70 kg KG entspricht dies 210 bzw. 280mg). Die toxische Schwellendosis beginnt bei mehr als 4mg/kg KG, wobei epileptische bzw. Krampfanfälle bei einer Dosis von 10mg/kh KG angegeben werden. [1] Weitere Kontraindikationen (vgl. „Rote Liste„) sind neben der Schwangerschaft, eine schriftlich nachgewiesene Allergie (als Basophilen-Degranulationstest), therapieresistente Orthostase, arterielle Hypotonie bzw. dekomp. Herzinsuffizienz, der AV-Block II/III° sowie die o.g. dekompensierte Hepatopathie mit erhöhten Transaminasen, Histamin- und Cholesterin-Werten, erniedrigten Synthesewerten wie Calcidiol (25-OH-Vitamin D), Diaminoxidase, LDH und Gerinnungsanomalien.
Das aus der Stomatologie bekannte und „jüngere“ Mepivacain ist prinzipiell mit Lidocain vergleichbar, wobei es etwas länger wirkt (90-180min) und auch als 3%ige Lösung angewendet werden kann. Die therapeutische Dosis wird mit ca. 4 mg/kg KG als Injektion angegeben (bei 70kg KG wäre dies 280mg), wobei die toxische Schwellendosis erst bei 9,8mg/kg KG liegt. [1] Wegen der besseren Penetration wende ich es nach den Empfehlungen meiner Kollegen v.a. bei der Quaddeltherapie und in Kombination mit Procain bei der lokoregionalen Infiltration von Narben, kleineren Nerven, ausgewählten Ganglien und Zähnen bzw. am Odonton an.